Содержание
- 1 История открытия
- 2 Монооксид углерода в атмосфере Земли
- 3 Получение
- 4 Физиологическое действие, токсичность
- 5 Свойства
- 6 Определение монооксида углерода
- 7 Применение
- 8 См. также
- 9 Литература
- 10 Ссылки
- 10.1 Смотреть что такое "Угарный газ" в других словарях:
- 10.2 Печальная статистика
- 10.3 Как работает «молчаливый убийца»
- 10.4 Коты, румянец и Чейн-Стокс: симптомы отравления
- 10.5 Раздеть, накрыть, угостить чашечкой кофе: как помочь угоревшему
- 10.6 Как правильно предохраняться
- 10.7 Когда угарный газ — друг
- 10.8 Почему умирают от вдыхания угарного газа
- 11 Оксид углерода CO2(IV) – углекислый газ
Молекула CO, так же, как и изоэлектронная ей молекула азота, имеет тройную связь. Так как эти молекулы сходны по строению, то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой :C≡O:, причём третья связь образована по донорно-акцепторному механизму, где углерод является акцептором электронной пары, а кислород — донором.
Согласно методу молекулярных орбиталей электронная конфигурация невозбуждённой молекулы CO σ 2 Oσ 2 zπ 4 x, yσ 2 C. Тройная связь образована σ—связью, образованной за счёт σz электронной пары, а электроны дважды вырожденного уровня πx, y соответствуют двум σ—связям. Электроны на несвязывающих σC—орбитали и σO—орбитали соответствуют двум электронным парам, одна из которых локализована у атома углерода, другая — у атома кислорода.
Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13Å).
Молекула слабо поляризована, электрический момент её диполя μ = 0,04·10 -29 Кл·м (направление дипольного момента O – →C + ). Ионизационный потенциал 14,0 в, силовая константа связи k = 18,6.
История открытия
Монооксид углерода был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем. То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крукшэнк. Моноксид углерода вне атмосферы Земли впервые был обнаружен бельгийским ученым М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК спектре Солнца.
Монооксид углерода в атмосфере Земли
Различают природные и антропогенные источники поступления в атмосферу Земли. В естественных условиях, на поверхности Земли, CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров. Монооксид углерода образуется в почве как биологическим путём (выделение живыми организмами), так и небиологическим. Экспериментально доказано выделение монооксида углерода за счёт обычных в почвах фенольных соединений, содержащих группы OCH3 или OH в орто- или пара-положениях по отношению к первой гидроксильной группе.
Общий баланс продуцирования небиологического CO и его окисления микроорганизмами зависит от конкретных экологических условий, в первую очередь от влажности и значения pH. Например, из аридных почв монооксид углерода выделяется непосредственно в атмосферу, создавая таким образом локальные максимумы концентрации этого газа.
В атмосфере СО является продуктом цепочек реакций с участием метана и других углеводородов (в первую очередь, изопрена).
Основным антропогенным источником CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Оксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления CO в CO2). В прошлом значительную долю антропогенного поступления CO в атмосферу обеспечивал светильный газ, использовавшийся для освещения помещений в XIX веке. По составу он примерно соответствовал водяному газу, то есть содержал до 45 % монооксида углерода. В настоящее время в коммунальной сфере этот газ вытеснен гораздо менее токсичным природным газом (низшие представители гомологического ряда алканов — пропан и др.)
Поступление CO от природных и антропогенных источников примерно одинаково.
Монооксид углерода в атмосфере находится в быстром круговороте: среднее время его пребывания составляет около 0,1 года, окисляясь гидроксилом до диоксида углерода.
Получение
Промышленный способ
1. Образуется при горении углерода или соединений на его основе (например, бензина) в условиях недостатка кислорода:
2. или при восстановлении диоксида углерода раскалённым углём:
Эта реакция часто происходит при печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли). Образующийся при этом монооксид углерода, вследствие своей ядовитости, вызывает физиологические расстройства («угар») и даже смерть (см. ниже), отсюда и одно из тривиальных названий — «угарный газ». Картина протекающих в печи реакций приведена на схеме.
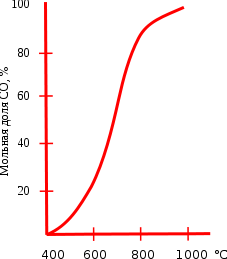
Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400°C равновесие практически полностью сдвинуто влево, а при температуре выше 1000°C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому монооксид углерода при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
3. Смеси монооксида углерода с другими веществами получают при пропускании воздуха, водяного пара и т. п. сквозь слой раскалённого кокса, каменного или бурого угля и т. п. (см. генераторный газ, водяной газ, смешанный газ, синтез-газ).
Лабораторный способ
1. Разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5. Схема реакции:
Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:
2. Нагревание смеси щавелевой и концентрированной серной кислот. Реакция идёт по уравнению:
Выделяющийся совместно с CO диоксид углерода можно удалить, пропустив смесь через баритовую воду.
3. Нагревание смеси гексацианоферрата (II) калия с концентрированной серной кислотой. Реакция идёт по уравнению:
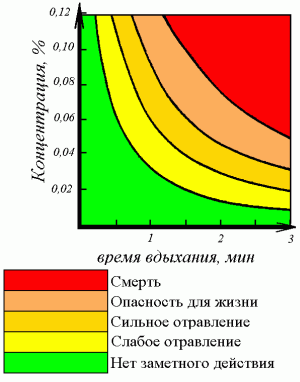
Физиологическое действие, токсичность
Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть. Признаками отравления служат головная боль, головокружение и потеря сознания. Токсическое действие монооксида углерода основано на том, что он связывается с гемоглобином крови прочнее, чем кислород (при этом образуется карбоксигемоглобин), таким образом, блокируя процессы транспортировки кислорода и клеточного дыхания. Предельно допустимая концентрация монооксида углерода в воздухе промышленных предприятий составляет 0,02 мг/л. Концентрация более 0,1 % — смертельна. В выхлопе бензинового автомобиля допускается до 1,5-3 %.
Опытами на молодых крысах выяснено, что 0,02-процентная концентрация CO в воздухе замедляет их рост и снижает активность по сравнению с контрольной группой. Интересно то, что крысы, живущие в атмосфере с повышенным содержанием CO, предпочитали воде и раствору глюкозы спиртовой раствор в качестве питья (в отличие от контрольной группы, особи в которой предпочитали воду).
Помощь при отравлении монооксидом углерода: пострадавшего следует вынести на свежий воздух, полезно также кратковременное вдыхание паров нашатырного спирта.
TLV (предельная пороговая концентрация, США): 25 ПДКр.з. по Гигиеническим нормативам ГН 2.2.5.1313—03 составляет 20 мг/м³
Защита от монооксида углерода
CO очень слабо поглощается активированным углём обычных фильтрующих противогазов, поэтому для защиты от него применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) — гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух.
Свойства
Монооксид углерода представляет собой бесцветный газ без вкуса и запаха. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
| Стандартная энергия Гиббса образования ΔG | −137,14 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 197,54 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 29,11 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHпл | 0,838 кДж/моль |
| Энтальпия кипения ΔHкип | 6,04 кДж/моль |
| Критическая температура tкрит | −140,23°C |
| Критическое давление Pкрит | 3,499 МПа |
| Критическая плотность ρкрит | 0,301 г/см 3 |
Основными типами химических реакций, в которых участвует монооксид углерода, являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах (так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже).
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830°C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции:
до 830°С смещено вправо, выше 830°C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Монооксид углерода горит синим пламенем (температура начала реакции 700°C) на воздухе:
Температура горения CO может достигать 2100°C, она является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления.
Монооксид углерода реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42°C, кипения +16°C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200°C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
Монооксид углерода реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
Получены также аналогичные селеноксид COSe и теллуроксид COTe.
C переходными металлами образует очень летучие, горючие и ядовитые соединения — карбонилы, такие как Cr(CO)6, Ni(CO)4, Mn2CO10, Co2(CO)9 и др.
Как указано выше, монооксид углерода незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако с расплавами щелочей вступает в реакцию:
Интересна реакция монооксида углерода с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
2K + 2CO → K + O – —C2—O – K +
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (оксид тория ThO2) по уравнению:
Определение монооксида углерода
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
Эта реакция очень чувствительная. Стандартный раствор 1 грамма хлорида палладия на литр воды.
Количественное определение монооксида углерода основано на иодометрической реакции:
Применение
- Моноксид углерода применяется для обработки мяса животных и рыбы, придает им ярко красный цвет и вид свежести, не изменяя вкуса (en:Clear smoke или en:Tasteless smoke технология). Допустимая концентрация CO равна 200 мг/кг мяса.
- Инсульт (ОНМК) – новые методы лечения.
См. также
Литература
- Ахметов Н. С. Общая и неорганическая химия. 5-е изд., испр. — М.: Высш. шк.; 2003 ISBN 5-06-003363-5
- Некрасов Б. В. Основы общей химии. Т. I, изд. 3-е, испр. и доп. Изд-во «Химия», 1973 г. Стр. 495—497, 511—513
- Химия: Справ. из./В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Перс. с нем. 2-е изд., стереотип. — М.:Химия, 2000 ISBN 5-7245-0360-3 (рус.)
Ссылки
Wikimedia Foundation . 2010 .
Смотреть что такое "Угарный газ" в других словарях:
УГАРНЫЙ ГАЗ — (монооксид углерода, СО), бесцветный, лишенный запаха ядовитый газ, который образуется при неполном сгорании ископаемых топлив; он присутствует, например, в составе угольного газа и выхлопных газов автомобилей. Ядовитое действие угарного газа… … Научно-технический энциклопедический словарь
Угарный газ — оксид углеродa, CO (a. carbon monox >Геологическая энциклопедия
угарный газ — сущ., кол во синонимов: 2 • газ (55) • угар (22) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
УГАРНЫЙ ГАЗ — (монооксид углерода, оксид углерода, СО) продукт неполного окисления углерода и его соединений (в печи, двигателе и др.), чрезвычайно ядовитый газ (вызывает отравление организма угар (см. (1))) без цвета, запаха и вкуса, плохо растворим в воде.… … Большая политехническая энциклопедия
УГАРНЫЙ ГАЗ — УГАРНЫЙ ГАЗ, то же, что углерода оксид … Современная энциклопедия
УГАРНЫЙ ГАЗ — то же, что углерода оксид … Большой Энциклопедический словарь
УГАРНЫЙ ГАЗ — неполный окисел углерода, возникающий в условиях горения при недостатке кислорода воздуха. У. г. не имеет цвета, вкуса и запаха, ядовит; при содержании его в воздухе от 0,02% отравляет организм, а потому во всех цехах, в к рых может возникнуть… … Технический железнодорожный словарь
Угарный газ — см. Оксид углерода … Российская энциклопедия по охране труда
Угарный газ — УГАРНЫЙ ГАЗ, то же, что углерода оксид. … Иллюстрированный энциклопедический словарь
угарный газ — то же, что оксид углерода. * * * УГАРНЫЙ ГАЗ УГАРНЫЙ ГАЗ, то же, что углерода оксид (см. УГЛЕРОДА ОКСИД) … Энциклопедический словарь
Летом многие стараются почаще и подольше бывать в краях непуганых коз и коров — в деревне или хотя бы просто на даче. Идеально, если там есть баня и какое-никакое отопление (мало ли какие заморозки ударят). Но уже при подготовке к дороге — в гараже, а потом на автостраде, в бане, в доме с печкой, даже в кальяне — нас подстерегает коварный и незаметный враг. Угарный газ.
Печальная статистика
Угарный газ, или моноксид углерода (его формула — СО) образуется при горении любых веществ и материалов, содержащих углерод. Это уголь, нефть, дрова, природный газ — всё, что сжигают для получения энергии. СО обильно выделяется при пожарах — многие жертвы погибают от него, а вовсе не от огня. Отравление угарным газом очень опасно для жизни и здоровья, оно легко приводит к летальному исходу.
Статистика говорит, что в России за последние 12 лет только из-за нарушений правил безопасности при обращении с отопительным оборудованием и газовыми плитами погибли 3364 человека. Половина из них умерли, отравившись угарным газом.
В других странах, особенно если там не слишком тёплый климат, а центрального отопления нет, ситуация не лучше. Например, в Великобритании ежегодно регистрируется в среднем 50 смертельных случаев бытовых отравлений СО — из-за неправильного использования каминов и других обогревательных систем.

Кроме бытовых, есть еще и производственные случаи отравления угарным газом: он используется в качестве сырья во многих химических производствах. Он — промежуточный реагент при реакциях с водородом, в которых получают органические спирты и неразветвленные углеводороды. А еще моноксидом углерода обрабатывают мясо и рыбу: это придает волокнам ярко-красный цвет и свежий вид, не изменяя вкуса.
Как работает «молчаливый убийца»
У СО нет ни вкуса, ни цвета, ни запаха, он не раздражает дыхательные пути и кожу, легко смешивается с воздухом. За это его и назвали «молчаливым убийцей».
Фатальное действие угарного газа основано на том, что он «сотрудничает» с гемоглобином. Этот белок находится в эритроцитах (красных кровяных тельцах). Именно благодаря ему мы дышим: гемоглобин подхватывает в легких кислород (и превращается в оксигемоглобин) и переносит его с током крови к органам и тканям человека.
СО связывается с гемоглобином прочнее и легче, чем кислород. Он образует карбоксигемоглобин, который ничем не может помочь организму, желающему дышать. Коварное вещество не отдает кислород, «запирает» в крови: ведет себя как собака на сене.
Кровь насыщается кислородом, становясь все краснее и краснее, а органы задыхаются. Смерть наступает от удушья, причем человек это замечает очень не сразу — можно дотянуть до того момента, когда помочь уже ничем нельзя.
Моя бабушка, которая больше половины своей жизни прожила в домах без центрального отопления, всегда предостерегала меня перед поездкой в деревню: «Смотри не угори». Сейчас печек стало меньше, глаголом «угорать» уже перестали пугать детей (по крайней мере, городских). Из-за этого многие (и не только дети) почему-то подумали, что угорать — это просто дезориентироваться в пространстве и времени без последствий. Сегодня это слово используют в контексте «смеяться, веселиться». Некоторые даже путают угарный газ с веселящим (хотя это совсем другое вещество, закись азота, N2O).
Мало кто задумывается о том, что даже «немножко угорев», надышавшись СО, можно получить необратимые повреждения мозга, и остаться на всю жизнь «угорелым». Практически как в анекдоте: «она теперь до сих пор в каске ходит и улыбается».
Коты, румянец и Чейн-Стокс: симптомы отравления
Начавшееся отравление диагностируется только по симптомам. Например, из-за кислородного голодания мозга развивается дезориентированность движений.
Помните народную метафору «метаться как угорелый»? Изначально в нее добавлялось слово «кот». Гоголь в «Ревизоре» об этом нам напоминает: «Что за ветреность такая! Вдруг вбежала как угорелая кошка». И действительно, кошки действительно начинают чувствовать симптомы отравления угарным газом раньше — просто они весят намного меньше нас. Аномальное поведение угорелых котов в свое время спасло немало семей.
У «молчаливого» убийцы жестокое чувство юмора — благодаря тому, что кровь прололжает насыщаться гемоглобином, у жертв сохраняется здоровый румянец. Поэтому и сложно со стороны диагностировать отравление и удушье, ведь в большинстве случаев при нехватке кислорода человек бледнеет или даже синеет.

Несмертельные отравления угарным газом могут вызывать тошноту, головокружение и нарушения работы мозга. Если человек получил большую дозу (например, долго находился в бане с горящими дровами и закрытой заслонкой печи), у него могут появиться галлюцинации, он теряет сознание, начинаются конвульсии и развивается дыхание Чейна-Стокса.
Раздеть, накрыть, угостить чашечкой кофе: как помочь угоревшему
При первом же подозрении на отравление угарным газом надо вызывать скорую помощь. Антидота, нейтрализующего действие СО, не существует: вся медицинская помощь будет сводиться к тому, чтобы максимально насытить кислородом оставшийся в рабочем состоянии гемоглобин.
До приезда скорой надо обеспечить пострадавшему возможность дышать полной грудью: снять тесную одежду, обязательно вынести на свежий воздух. Если он в сознании и способен глотать — напоите его кофе или крепким чаем: кофеин стимулирует дыхательный центр в мозге.
Обязательно накройте человека одеялом или теплой одеждой: при отравлении моноксидом углерода нарушается терморегуляция, и можно переохладиться, даже если температура комфортна для здоровых людей.
Внимание: все эти меры помогут лишь при легкой степени воздействия СО. Угарный газ — очень сильный яд, и при тяжелом отравлении медицина, увы, бессильна.
Как правильно предохраняться
Надеюсь, что достаточно вас напугал, и теперь вы понимаете, почему надо внимательно относиться к профилактике отравления угарным газом.
Во-первых, нужно регулярно проверять отопительную технику, если вы обогреваетесь не стандартными городскими батареями, а, например, газовым котлом или русской печью. Вызывайте специалистов примерно раз в год, пусть проводят полную инспекцию.
Во-вторых, если вы топите баню, ни в коем случае не находитесь в ней, когда заслонка печи закрыта, а угли еще красные: это значит, что процесс горения еще не кончился, СО еще выделяется, но в трубу не уходит, а остается внутри помещения.
В-третьих, нельзя перекрывать всю вентиляцию в помещении. Даже ради экономии тепла.
В-четвертых, если у вас коттедж или дачный дом с собственной системой отопления — вы автоматически в группе риска. Установите в доме датчики угарного газа.
Если зафиксирована утечка, срочно покидайте помещение. Вас не защитят респиратор или даже противогаз с угольным фильтром — молекула угарного газа очень маленькая, она легко пройдет через фильтры.
Если дома с печкой у вас нет, не торопитесь расслабляться. Особенно если любите кальян. В процессе курения можно запросто получить легкое отравление угарным газом. Головные боли, головокружение, тошнота, сонливость после кальяна — его яркие симптомы. Угарный газ в этом случае накапливается, если в кальян поступает недостаточно кислорода.
Когда угарный газ — друг
Моноксид углерода — не абсолютный враг, все дело опять в дозировке. Он вырабатывается и организмом человека. Скорее всего, этот атавизм остался нам от далеких-далеких предков, которые еще только вышли из воды на сушу. В те времена в атмосфере было очень много СО, и некоторые базовые биологические механизмы зародились именно тогда, с использованием этой молекулы.
Мы вырабатываем 3–6 мл угарного газа в день (такой СО называется эндогенным), а если в организме есть воспаления — то и больше. Эндогенный угарный газ служит человеку: он регулирует кровяное давление при стрессах. Есть данные о том, что он участвует в защите нервных клеток при апоплексии и болезни Альцгеймера.
Оксид углерода CO(II) или монооксид углерода – бесцветный газ, не имеющий запаха, плохо растворимый в воде.
Оксид углерода CO(II) рядовому обывателю более известен, как угарный газ, который стал причиной трагических смертей десятков тысяч людей.
В молекуле оксида углерода (II) атомы кислорода и углерода соединены тройной связью.
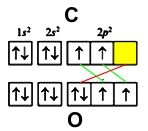
- кислорода – 1s 2 2s 2 2p 4
- углерода – 1s 2 2s 2 2p 2
У обоих элементов имеется по два неспаренных электрона на внешнем энергетическом уровне, которые и образуют две ковалентные связи (обозначены зеленым цветом). Третья связь образуется по донорно-акцепторному принципу – атом углерода (акцептор) предоставляет свою свободную орбиталь (желтая ячейка), на которой размещается электронная пара кислорода (донор) (красный цвет).
В молекуле угарного газа атом углерода принимает валентность 3, но степень окисления +2. По этой причине, для оксида углерода CO(II) характерны реакции присоединения, в которых он играет роль восстановителя:
- на воздухе оксид углерода CO(II) горит, образуя углекислый газ:
2C +2 O+O2 0 = 2C +4 O2↑+Q - восстановительные свойства угарного газа нашли широкое применение в металлургических процессах получения металлов из их оксидов (руд):
CO+FeO = CO2↑+Fe
CO+CuO = CO2↑+Cu - в присутствии угля, который выполняет роль катализатора, на свету угарный газ взаимодействует с хлором с образованием отравляющего вещества фосген:
CO+Cl2 = COCl2
Поскольку монооксид углерода не образует солей, при н.у. угарный газ не взаимодействует с кислотами и щелочами.
В промышленных целях угарный газ получают взаимодействием углекислого газа с раскаленным углем:
CO2+C = 2CO
В лабораторных условиях CO получают действием концентрированной серной кислоты на муравьиную кислоту при высокой температуре:
HCOOH → CO↑ + H2O
Угарный газ также образуется в процессе неполного сгорания топлива:
CH4+1½O2 = CO+2H2O
Именно такие случаи приводят зачастую к непоправимым трагедиям, – люди "угорают", чаще всего в домах с печным отоплением, когда в целях сохранения тепла на ночь закрывается заслонка, препятствующая выходу продуктов горения в вытяжную трубу, но при этом дрова или уголь еще полностью не перегорели. В результате чего, образующийся угарный газ накапливается в помещении, и люди, вдыхая его во сне, умирают.
Второй, самый распространенный случай гибели людей от угарного газа – вдыхание выхлопных газов автомобиля с двигателем внутреннего сгорания в закрытом, плохо проветриваемом помещении. Сколько таких случаев было, когда водители грелись и погибали в закрытых гаражах.
Почему умирают от вдыхания угарного газа
Все дело в гемоглобине, который содержится в красных кровяных тельцах – эритроцитах. Гемоглобин – это белок, который транспортирует кислород от легких к тканям человека. Коварность угарного газа заключается в том, что CO легко преодолевает альвеолярно-капиллярную мембрану, после чего растворяется в плазме крови, и начинает "цепляться" к эритроцитам, вытесняя из гемоглобина кислород с образованием карбоксигемоглобина – в молекуле гемоглобина молекулы угарного газа соединяются с атомами железа, после чего кислород остается "не при делах". Данная реакция происходит по причине того, что монооксид углерода в 250(!) раз более активно вступает в реакцию с гемоглобином, нежели кислород. Таким образом, поступление кислорода к тканям организма нарушается, и в течение короткого времени наступает смерть человека, который задыхается "изнутри".
Концентрация угарного газа 1,2% в воздухе является смертельной – достаточно всего нескольких вдохов, чтобы человек потерял сознание, смерть наступает в течение 2-3 минут.
Оксид углерода CO2(IV) – углекислый газ
Молекула углекислого газа имеет линейное строение (углерод имеет валентность 4, и степень окисления +4):
Атомы углерода и кислорода связаны ковалентными полярными связями, но сама молекула неполярна.
Углекислый газ (диоксид углерода) также, как и угарный газ, не имеет цвета, запаха, плохо растворим в воде, но, растворяется лучше, чем CO. При низких температурах углекислота переходит в жидкое, а затем в твердое состояние (сухой лед).
Углекислый газ реагирует со следующими веществами:
- при растворении в воде образует угольную кислоту:
CO2+H2O = H2CO3 - с основными оксидами и основаниями CO2 взаимодействует, как кислотный оксид, образуя соли, которые называются карбонатами:
Na2O+CO2 = Na2CO3 - при высоких температурах углекислый газ проявляется свойства окислителя – активные металлы могут гореть в среде углекислого газа, отнимая у него кислород:
CO2+C = 2CO
CO2+2Mg = 2MgO+C
Получение и применение углекислого газа
- в промышленности – обжигом известняка:
CaCO3 = CaO+CO2↑ - в лаборатории – действием кислоты на соли угольной кислоты:
Na2CO3+2HCl = 2NaCl+H2O+CO2↑ - в природе углекислый газ выделяется при гниении и горении органических веществ:
C+O2 = CO2↑
Углекислый газ нашел широкое применение в пищевой промышленности, в качестве основного компонента газированных напитков. Сухой лед применяется в качестве охладителя. Углекислотные огнетушители применяются при тушении похара, если температура горения не превышает 1000°C.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:

Код кнопки: 
Политика конфиденциальности Об авторе