Содержание
- 1 Общие сведения
- 2 Наименования продукта
- 3 Тип пищевой добавки
- 4 Упаковывание и применение
- 5 Польза и вред
- 6 Применение в других сферах
- 7 Что такое медный купорос?
- 8 Применение медного купороса в садоводстве
- 9 Как приготовить раствор медного купороса?
- 10 Обработка медным купоросом весной
- 11 Летняя обработка
- 12 Особенности осенней обработки медным купоросом
- 13 Меры предосторожности
- 14 Содержание
- 15 Нахождение в природе [ править | править код ]
- 16 Получение [ править | править код ]
- 17 Физические свойства [ править | править код ]
- 18 Химические свойства [ править | править код ]
- 18.1 Электролитическая диссоциация [ править | править код ]
- 18.2 Реакция замещения [ править | править код ]
- 18.3 Реакция с растворимыми основаниями (щелочами) [ править | править код ]
- 18.4 Сокращённое ионное уравнение (Правило Бертолле) [ править | править код ]
- 18.5 Реакция обмена с другими солями [ править | править код ]
- 18.6 Прочее [ править | править код ]
- 19 Производство и применение [ править | править код ]
- 20 Токсикология [ править | править код ]
 Сульфат меди относится к пищевым добавкам, которые получаются в результате химической реакции между серной кислотой и производным металлом. Согласно общепринятым стандартам классифицируется под номером Е519. Добывают исключительно синтетическим способом. Готовая продукция имеет некоторые свойства эмульгатора. Чаще всего применяется в качестве консерванта. Сульфат меди полностью безопасен для человеческого организма.
Сульфат меди относится к пищевым добавкам, которые получаются в результате химической реакции между серной кислотой и производным металлом. Согласно общепринятым стандартам классифицируется под номером Е519. Добывают исключительно синтетическим способом. Готовая продукция имеет некоторые свойства эмульгатора. Чаще всего применяется в качестве консерванта. Сульфат меди полностью безопасен для человеческого организма.
Общие сведения
Согласно химическим справочникам, имеет распространенное наименование – медный купорос, формула которого CuSO4. Главным отличием различных видов этого вещества является насыщение жидкостью – водой.
Помимо пентагидрата можно встретить схожий по формуле безводный сульфат, который имеет серо-белый или слегка зеленоватый оттенок. Также существует минерал Бонатит, который называется тригидратом.
Стандартный медный купорос имеет вид кристаллов характерного синего цвета. При употреблении человеком чувствуется слегка металлический привкус. Вещество способно растворяться в воде, метиловом спирте и соляной кислоте.
Некоторое время тому назад Е519 была доступна в пищевой промышленности Российской Федерации. С ее помощью создавали необычный синеватый цвет каких-либо продуктов, использовали как один из лучших консервантов. Наиболее распространенным считается изготовление маслин. В 2010 году на использование медного купороса наложили вето. Несмотря на общепринятое употребление в пищу, современные исследования доказывают некоторое токсическое воздействие, приводящее к мутациям внутри организма.
Наименования продукта
В общепринятых стандартах указывается официальное наименование сульфат меди. В международном обществе принято наименование Cupric Sulphate.
Помимо пищевой промышленности, Е519 используют в фармацевтике, фотографии, сельском хозяйстве, текстильной отрасли.
В странах Европейского союза пищевую добавку называют согласно шифрованному коду – Е519 (иногда указывается с тире между буквой и цифрами).
 Среди промышленников или работников химической отрасли известны и другие наименования. Самыми популярными считаются медный купорос, кристаллогидрат, двухвалентная сернокислая медь, отдельные названия на немецком и французском языках.
Среди промышленников или работников химической отрасли известны и другие наименования. Самыми популярными считаются медный купорос, кристаллогидрат, двухвалентная сернокислая медь, отдельные названия на немецком и французском языках.
Тип пищевой добавки
Вещество официально зарегистрировано как стабилизатор, применяемый при изготовлении еды или продуктов питания. В природном виде его можно встретить в некоторых минералах. Это бутит или халькантит. Несмотря на природное происхождение самого источника, вещество неорганическое, относящееся к бинарным соединениям.
С целью применения медного купороса в промышленности, медь растворяют в ранее подогретой серной кислоте. При этом обеспечивается обдувание воздухом. Альтернативным вариантом считается окислительный обжиг. В этом случае окись меди взаимодействует с серной кислотой
Очистка готового продукта подразумевает образование новых кристаллов в дистиллированной воде, которая подвергается процессу кипения. В результате охлаждения образуется осадок, выделяемый из вещества посредством применения специальных фильтров.
| Показатель | Свойства |
|---|---|
| Цвет | Без цвета; в форме кристаллов – синий, бирюзовый или голубой |
| Состав | Сернокислая медь с формулой CuSO4 |
| Внешняя форма | Порошок, кристаллы или кристаллические гранулы |
| Аромат | Нет |
| Растворимость в жидкостях | В воде, метаноле и серной кислоте; нерастворим в этаноле |
| Количество основного компонента | Не менее 98% |
| Вкусовые качества | Неприятный, имеющий вкрапление металла |
| Плотность | 3,64 г/см 3 |
| Прочие | При воздействии открытого пространства теряется цвет; повышенная гигроскопичность |
Упаковывание и применение
 Сульфат меди, согласно общепринятым стандартам, упаковывается в специальные мешки. Их создают из полипропилена или бумаги, состоящей из нескольких слоев. Внутри подобной тары обязательно имеется вставка из полиэтилена. При использовании не в пищевой промышленности фасуется во флаконы или банки, изготовленные из пластика. Реже встречается в пакетах из фольги или полиэтилена.
Сульфат меди, согласно общепринятым стандартам, упаковывается в специальные мешки. Их создают из полипропилена или бумаги, состоящей из нескольких слоев. Внутри подобной тары обязательно имеется вставка из полиэтилена. При использовании не в пищевой промышленности фасуется во флаконы или банки, изготовленные из пластика. Реже встречается в пакетах из фольги или полиэтилена.
В современном обществе применение пищевой добавки Е519 запрещается законодательством некоторых стран, в том числе и Российской Федерацией. Процедура исключения была проведена в 2010 году, когда некоторые независимые исследования указали на вред для человеческого организма. Также запрещено использование в Норвегии, некоторых странах Европейского союза, Великобритании и государствах ЕАЭС. До сих пор разрешается применение в Японии, частично – в Украине. Сведения о сульфате меди в Соединенных Штатах Америки отсутствуют.
Польза и вред
Многочисленные современные научные исследовательские центры, проведя точное изучение всех возможных последствий влияния на человеческий организм пищевой добавки Е519, пришли к выводу о ее опасности – присвоен второй класс опасности. Причиной такой ситуации считается возможность накопления вещества в печени и почках, причиняя непоправимый вред организму.
Особенно опасным считается случайное проглатывание пищевой добавки. Токсичное воздействие начинает проявляться в зависимости от возраста человека, массы его тела, общего состояния. Средние показатели свидетельствуют примерно о 0,5 г, приводящих к серьезным нарушениям здоровья.
Стандартными симптомами при отравлении считаются тошнота, позывы к рвоте, появление ожогов на слизистых оболочках, диарея, непроизвольные судороги, сопровождаемые изменением ритма сердечных сокращений. Организм начинает быстро терять воду.
При проявлении подобных симптомов рекомендуется незамедлительно вызывать врача. Пациенту проводят промывание желудка. Для этой цели используется раствор перманганата калия (0,1%), прописывается до 2 ложек сульфата магния (предпочтительно вводить внутривенно).
Опасны и испарения сернокислой меди, которые могут вызвать отек легких при частом вдыхании. При необходимости проведения работ с минеральными удобрениями, рекомендуется использовать респиратор. По их окончанию – тщательно вымываются руки и лицо. Доза, равная 45 г вещества, приводит к летальному исходу.
Применение в других сферах
Сульфат меди разрешено использовать в других сферах деятельности человека – это медицина, сельское хозяйство и ветеринария.
Е915 считается одним из самых сильнодействующих антисептиков. Нередко используется с целью ускорения выработки гемоглобина, а также снимает негативное воздействие отравляющих организм человека фосфорных соединений. Принимается внутрь для эффективного и быстрого очищения желудка посредством выведения содержимого в виде рвоты. Распространено лечение некоторых инфекционных заболеваний, а также анемии.
В сельском хозяйстве является отличным фунгицидом. Используется с целью избавления растений от многих паразитов и микроорганизмов, а также грибковых инфекций. Раствором медного купороса обрабатывают землю перед посевом. Редко используется как удобрение с целью обогащения медью.
В ветеринарии применяется как антисептик и антигельминтное средство. При опрыскивании стойла, исчезают комары и блохи. Обрабатываются и конечности животного с целью излечения от дерматита, язв и прочих недугов. Пищевая добавка Е519 используется с целью излечения от различных инфекций аквариумных рыбок.

Медный купорос очень популярное средство, используемое в огороде и в саду. Это препарат контактного действия, который можно использовать для борьбы с болезнями, вредителями и в некоторых других случаях. О том, что это за вещество и как его применять, можно прочесть ниже в статье.
Что такое медный купорос?

Медный купорос также именуют сульфатом меди или сернокислой медью. Его химическая формула CuSO4. Выглядит это вещество как кристаллический голубо-синий порошок, но при длительном контакте с воздухом он бледнеет, становясь светло-серыми. А как только его замачивают в воде – возобновляет свой синеватый цвет. На качество медного купороса это никак не влияет, он все еще пригоден к использованию, но об этом его свойстве важно знать при использовании.
Продается сульфат меди в любом магазине с садовыми товарами. Как правило, его фасуют по пакетикам с надписью «Медный купорос» или «CuSO4». Он также входит в состав таких препаратов как: «Купронафт», «Бордоская смесь», «Бургундская жидкость» и подобных.
Применение медного купороса в садоводстве



Одним из наиболее доступных и одновременно эффективных препаратов для сада считается медный купорос. Как же его используют?

- Для повышения иммунной системы растений данным препаратом опрыскивают культуры.
- Он борется с вредными насекомыми.
- Сульфат меди способен справиться с грибковыми и многими другими заболеваниями.
- Восстанавливает культуры после плодоношения или некоторых тяжелых заболеваний.
- Обработка мест срезов пагонов деревьев и кустарников.
- Как удобрение садовых и огородных культур.
Как приготовить раствор медного купороса?

Медный купорос как приготовить
В зависимости от того, для чего используется медный купорос, рецепт приготовления раствора может значительно различаться.
- 3-5% растворы считаются выжигающими. Их используют для того, чтобы обеззаразить землю, устранить плесень. Это довольно концентрированная смесь, поэтому обработанную ею землю можно использовать не раньше чем через год. Для изготовления растворяют в 10 литрах воды 300-500 г CuSO4.
- 0,5-1% растворы считаются лечебно-профилактическими. Они используются для борьбы с грибковыми болезнями, вредителями и для обработки срезов на веточках, коре деревьев. Делается посредством растворения 50-100 г кристаллов медного купороса в 10 литрах воды.
- 0,02-0,03% раствор – это наиболее слабая концентрация, используемая как удобрение и подкормка для разных садовых культур. Для получения этой подкормки нужно растворить всего лишь 2-3 грамма кристаллов CuSO4 в 10 литрах воды.
Любые растворы медного купороса необходимо готовить непосредственно перед использованием, а не заранее, ведь медный купорос в холодной воде может снова кристаллизоваться.
Обработка медным купоросом весной



Чаще всего медный купорос в саду используется именно весной. В это время растениям необходимо много питательных элементов, чтобы пойти в рост, также большое количество меди потребляется во время цветения – это период наивысшей активности обменных процессов в тканях культур.
- Обработка растений раствором медного купороса обычно осуществляется посредством орошения ветвей и земли под культурой. Применяют его в этом случае и как лечение, и как профилактическую меру, а в качестве бонуса получают повышение иммунитета «пациента».
- Кроме ухода за культурами, весной медный купорос используют для обработки земли (как удобрение). Он не только обогащает землю медью, но и уничтожает грибки, вредителей, которые могут в ней обитать. Наиболее эффективная такая процедура перед посадкой редиса, моркови, капусты, чеснока и некоторых других растений, особенно уязвимых для негативного влияния окружающей среды.
- Еще один метод использования CuSO4 весной – протравливание клубней картофеля перед посадкой. Если обработать их раствором 0,2% концентрации, снизится риск заражения фитофторозом. Кроме того, такое опрыскивание улучшает вкус будущего урожая.
- Можно слабым раствором обработать и рассаду томатов, чтобы избежать возможности заражения грибками при пересадке на постоянное место.
- Если замочить семена культур в растворе медного купороса (слабом), можно защитить их от заболеваний и ускорить всхожесть. Однако такая обработка многими огородниками считается опасной. По их мнению, при такой обработке вещество не выводится из растения и может навредить пользе и вкусу урожая.
Летняя обработка

Применение медного купороса
Садоводы настоятельно рекомендуют не опрыскивать растения медным купоросом при температуре воздуха выше +30 градусов. Так что летом использование препарата сокращается к минимуму. Лишь при условии, когда требуются экстренные меры для лечения медного голодания у дерева или иной молодой культуры, можно использовать слабый раствор вещества. Обычно признаки медного голодания появляются в июле. Они выражаются в отмирании верхушек растений, слабом росте, хлорозе.
Использовать CuSO4 можно летом и для борьбы с белой гнилью, фитофторозом, черной ножкой. В данном случае нужен 0,2% раствор, а процедура проводится только под вечер.
Особенности осенней обработки медным купоросом

Осенняя обработка культур медным купоросом осуществляется исключительно после того, как деревья и кустарники сбросят листья. При этом температура должна быть плюсовой! Это снизит риск появления химических ожогов и поможет растению восстановиться после плодоношения.
Благодаря осенней обработке можно не только повысить сопротивляемость деревьев морозам, болезням, но и избавиться от вредителей, которые обычно селятся на зиму в их коре. Но опрыскивают не только дерево или кустарник, но и землю у его основания (прикорневую зону), так как там вредители также нередко поселяются.
Меры предосторожности

Медный купорос действительно невероятно полезное вещество. Однако использовать его нужно с умом, чтобы не навредить растениям, земле и даже людям, которые находятся в непосредственной близости во время его применения.
- Обработка растений проводится обычно рано утром или вечером, после захода солнца, иначе на листиках появятся ожоги.
- Использовать растворы можно только в безветренную погоду.
- Проку от опрыскивания после дождя или сразу перед ним никакого нет.
- Всегда нужно придерживаться правильной концентрации медного купороса! Растворы с концентрацией более 5% убивают любых вредителей, но и сами растения будут обожжены – не стоит об этом забывать.
- Сразу после применения средства необходимо вымыть садовый инвентарь.
- Медный купорос можно использовать только в спецодежде, перчатках, маске, чтобы не вдыхать пары и не допускать попадания вещества на кожу, в глаза.
- Опрыскивание допустимо до распускания почек и после листопада. Ни в коем случае нельзя распылять медный купорос во время цветения культур – это приведет к отравлению любых опылителей, включая пчел.
- Обработка медным купоросом проводится не позже чем за месяц до сбора урожая!
Не стоит забывать, что медный купорос ядовит для человека. Смертельная доза всего 50 мл. При этом он может всасываться через пот, усваиваться при попадании на любые слизистые оболочки. Поэтому при работе с CuSO4 нужно соблюдать меры индивидуальной защиты и аккуратно обращаться с раствором.
| Сульфат меди | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
сульфат меди(II) |
| Традиционные названия | пентагидрат: медный купорос |
| Хим. формула | Cu S O 4 |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 159,609 (сульфат) 249.685 (пентагидрат) г/моль |
| Плотность | 3,64 г/см³ |
| Твёрдость | 2,5 [1] |
| Термические свойства | |
| Т. разл. | выше 650 °C |
| Химические свойства | |
| pKa | 5⋅10 −3 |
| Структура | |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | безв. — ромбическая пентагидрат — триклинная пинакоидальная тригидрат — моноклинная |
| Классификация | |
| Рег. номер CAS | 7758-98-7 |
| PubChem | 24462 |
| Рег. номер EINECS | 231-847-6 |
| SMILES | |
| Кодекс Алиментариус | E519 |
| RTECS | GL8800000 |
| ChEBI | 23414 |
| ChemSpider | 22870 |
| Безопасность | |
| ПДК | в воздухе: мр 0,009, сс 0,004; в воде: 0,001 |
| ЛД50 |
крысы, орально [2] : 612,9 мг/кг мыши, орально: 87 мг/кг |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфа́т ме́ди(II) (медь серноки́слая, ме́дный купоро́с) — неорганическое соединение, медная соль серной кислоты с формулой Cu S O 4. Нелетучее вещество, не имеет запаха. В безводном виде — белый порошок, очень гигроскопичное. В виде кристаллогидратов — прозрачные негигроскопичные кристаллы различных оттенков синего с горьковато-металлическим вяжущим вкусом, на воздухе постепенно выветриваются (теряют кристаллизационную воду).
Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется голубой пентагидрат CuSO4·5H2O — медный купоро́с. Токсичность медного купороса для теплокровных животных относительно невысока, в то же время, он высокотоксичен для рыб.
Обладает дезинфицирующими, антисептическими, вяжущими свойствами. Применяется в медицине, в растениеводстве как антисептик, фунгицид или медно-серное удобрение.
Реакция гидратации безводного сульфата меди(II) экзотермическая и проходит со значительным выделением тепла.
Содержание
Нахождение в природе [ править | править код ]
Получение [ править | править код ]
В промышленности [ править | править код ]
В промышленности загрязнённый сульфат меди(II) получают растворением меди и медных отходов в разбавленной серной кислоте H2SO4 при продувании воздуха:
2 C u + O 2 + 2 H 2 S O 4 → 2 C u S O 4 + 2 H 2 O , <displaystyle <mathsf <2Cu+O_<2>+2H_<2>SO_<4>
ightarrow 2CuSO_<4>+2H_<2>O>>,>
C u O + H 2 S O 4 → C u S O 4 + H 2 O , <displaystyle <mathsf <2>SO_<4>
ightarrow CuSO_<4>+H_<2>O>>,>
сульфатизирующим обжигом сульфидов меди и как побочный продукт электролитического рафинирования меди.
В лабораторных условиях [ править | править код ]
В лаборатории CuSO4 можно получить действием концентрированной серной кислоты на медь при нагревании:
C u + 2 H 2 S O 4 → C u S O 4 + S O 2 ↑ + 2 H 2 O , <displaystyle <mathsf <2>SO_<4>
ightarrow CuSO_<4>+SO_<2>uparrow +2H_<2>O>>,>
температура не должна превышать 60 °С, при большей температуре в значительных количествах образуется побочный продукт — сульфид меди(I):
5 C u + 4 H 2 S O 4 → 3 C u S O 4 + C u 2 S ↓ + 4 H 2 O . <displaystyle <mathsf <5Cu+4H_<2>SO_<4>
ightarrow 3CuSO_<4>+Cu_<2>Sdownarrow +4H_<2>O>>.>
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди(II) серной кислотой, для получения сульфата меди высокой чистоты используют соответственно чистые реактивы:
C u ( O H ) 2 + H 2 S O 4 → C u S O 4 + 2 H 2 O . <displaystyle <mathsf <2>+H_<2>SO_<4>
ightarrow CuSO_<4>+2H_<2>O>>.>
Чистый сульфат меди может быть получен следующим образом. В фарфоровую чашку наливают 120 мл дистиллированной воды, прибавляют 46 мл химически чистой серной кислоты плотностью 1,8 г/см 3 и помещают в смесь 40 г чистой меди (например, электролитической). Затем нагревают до 70—80 °С и при этой температуре в течение часа постепенно, порциями по 1 мл, прибавляют 11 мл конц. азотной кислоты. Если медь покроется кристаллами, прибавить 10—20 мл воды. Когда реакция закончится (прекратится выделение пузырьков газа), остатки меди вынимают, а раствор упаривают до появления на поверхности плёнки кристаллов и дают остыть. Выпавшие кристаллы следует 2—3 перекристаллизовать из дистиллированной воды и высушить [4] .
Очистка [ править | править код ]
Очистить загрязнённый или технический сульфат меди можно перекристаллизацией — вещество растворяется в кипящей дистиллированной воде до насыщения раствора, после чего охлаждается до приблизительно +5 °С. Полученный осадок кристаллов отфильтровывается. Однако даже многократная перекристаллизация не позволяет избавиться от примеси соединений железа, которые являются наиболее распространённой примесью в сульфате меди.
Для полной очистки медный купорос кипятят с диоксидом свинца PbO2 или пероксидом бария BaO2, пока отфильтрованная проба раствора не покажет отсутствия железа. Затем раствор фильтруют и упаривают до появления на поверхности плёнки кристаллов, после чего охлаждают для кристаллизации [4] .
По Н. Шоорлю очистить сульфат меди можно так: к горячему раствору CuSO4 прибавить небольшие количества пероксида водорода H2O2 и гидроксида натрия NaOH, прокипятить и отфильтровать осадок. Выпавшие из фильтрата кристаллы дважды подвергаются перекристаллизации. Полученное вещество имеет чистоту не ниже квалификации «ХЧ» [4] .
Глубокая очистка [ править | править код ]
Существует более сложный способ очистки, позволяющий получить сульфат меди особой чистоты, с содержанием примесей около 2·10 -4 %.
Для этого готовится водный, насыщенный при 20°С раствор сульфата меди (вода используются только бидистиллированная). В него добавляют перекись водорода в количестве 2-3 мл 30 % раствора на 1 литр, перемешивают, вносят свежеосаждённый основной карбонат меди в количестве 3-5 грамм, нагревают и кипятят 10 минут для разложения H2O2.
Затем раствор охлаждают до 30—35 °С, фильтруют и приливают 15 мл 3%-ного раствора диэтилдитиокарбамата натрия и выдерживают в мешалке три-четыре часа не понижая температуры. Далее раствор быстро процеживают от крупных хлопьев комплексов и вносят активированный уголь БАУ-А на полчаса при перемешивании. Затем раствор следует отфильтровать вакуумным методом.
Дальше в раствор CuSO4 приливают на 1 л около 200 мл насыщенного раствора NaCl квалификации «Ч» и вносят чистый алюминий в проволоке или обрезках до полного прохождения реакции, выделения меди и просветления раствора (при этом выделяется водород). Выделенную медь отделяют от алюминия взбалтыванием, осадок промывают декантацией сперва водой затем заливают горячим 5—10 % раствором соляной кислоты ХЧ при взбалтывании в течение часа и постоянным подогревом до 70—80 °С, затем промывают водой и заливают 10—15%-ной серной кислотой (ОСЧ 20-4) на час с подогревом при том же интервале температур. От степени и тщательности промывания кислотами, а также квалификации применяемых далее реактивов зависит чистота дальнейших продуктов.
После промывки кислотами медь снова моют водой и растворяют в 15—20%-ной серной кислоте (ОСЧ 20-4) без её большого избытка с добавлением перекиси водорода (ОСЧ 15-3). После прохождения реакции полученный кислый раствор сульфата меди кипятят для разложения избытка перекиси и нейтрализуют до полного растворения вначале выпавшего осадка перегнанным 25%-ным раствором аммиака (ОСЧ 25-5) или приливают раствор карбоната аммония, очищенного комплексно-адсорбционным методом до особо чистого.
После выстаивания в течение суток раствор медленно фильтруют. В фильтрат добавляют серную кислоту (ОСЧ) до полного выпадения голубовато-зелёного осадка и выдерживают до укрупнения и перехода в зелёный основной сульфат меди. Зелёный осадок выстаивают до компактности и тщательно промывают водой до полного удаления растворимых примесей. Затем осадок растворяют в серной кислоте, фильтруют, устанавливают рН=2,5—3,0 и перекристаллизовывают два раза при быстром охлаждении, причем при охлаждении раствор каждый раз перемешивают для получения более мелких кристаллов сульфата меди. Выпавшие кристаллы переносят на воронку Бюхнера и удаляют остатки маточного раствора с помощью водоструйного насоса. Третья кристаллизация проводится без подкисления раствора с получением чуть более крупных и оформленных кристаллов [5] .
Физические свойства [ править | править код ]
Пентагидрат сульфата меди(II) (медный купорос) — синие прозрачные кристаллы триклинной сингонии. Плотность 2,284 г/см 3 . При температуре 110 °С отщепляется 4 молекулы воды, при 150 °С происходит полное обезвоживание [6] .
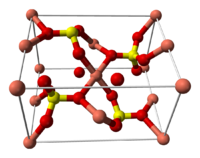
Строение кристаллогидрата [ править | править код ]
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.

Термическое воздействие [ править | править код ]
При нагревании пентагидрат последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4·3H2O (этот процесс, выветривание, медленно идёт и при более низких температурах [в том числе при 20—25 °С]), затем в моногидрат (при 110 °С) CuSO4·H2O, и выше 258 °C образуется безводная соль.
Выше 650 °C становится интенсивным пиролиз безводного сульфата по реакции:
2 C u S O 4 → o t 2 C u O + 2 S O 2 + O 2 <displaystyle <mathsf <2CuSO_<4><xrightarrow[<>]<^
Растворимость [ править | править код ]
Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80—200 °C). (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди(II) гидролизуется, (степень гидролиза в 0,01 М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5⋅10 −3 .
Химические свойства [ править | править код ]
Электролитическая диссоциация [ править | править код ]
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах сульфат меди(II) так же, как и все растворимые соли, диссоциирует в одну стадию:
C u S O 4 → C u 2 + + S O 4 2 − . <displaystyle <mathsf <4>
ightarrow Cu^<2+>+SO_<4>^<2->>>.>
Реакция замещения [ править | править код ]
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее чем медь, стоящих левее меди в электрохимическом ряду напряжения металлов:
C u S O 4 + Z n → C u ↓ + Z n S O 4 . <displaystyle <mathsf <4>+Zn
ightarrow Cudownarrow +ZnSO_<4>>>.>
Реакция с растворимыми основаниями (щелочами) [ править | править код ]
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета [7] :
C u S O 4 + 2 K O H → C u ( O H ) 2 ↓ + K 2 S O 4 <displaystyle <mathsf <4>+2KOH
ightarrow Cu(OH)_<2>downarrow +K_<2>SO_<4>>>> 
ightarrow Cu(OH)_<2>downarrow +Li_<2>SO_<4>>>> 
ightarrow Cu(OH)_<2>downarrow +Na_<2>SO_<4>>>>
Сокращённое ионное уравнение (Правило Бертолле) [ править | править код ]
Реакция обмена с другими солями [ править | править код ]
Сульфат меди вступает также в обменные реакции по ионам Cu 2+ и SO4 2-
C u S O 4 + B a C l 2 → C u C l 2 + B a S O 4 ↓ <displaystyle <mathsf <4>+BaCl_<2>
ightarrow CuCl_<2>+BaSO_<4>downarrow >>> 
ightarrow CuSdownarrow +K_<2>SO_<4>>>>
Прочее [ править | править код ]
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Ион Cu 2+ окрашивает пламя в зелёный цвет.
Производство и применение [ править | править код ]



Сульфат меди(II) — один из важнейших солей меди. Часто служит исходным сырьём для получения других соединений меди.
Безводный сульфат меди — хороший влагопоглотитель и может быть использован для абсолютирования этанола, осушения газов (в том числе воздуха) и как индикатор влажности.
Лёгкость выращивания кристаллов пентагидрата сульфата меди и их резкое различие с безводной формой используются в школьном образовании.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а также для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей, а также как антисептическое и фунгицидное средство для предотвращения гниения древесины.
В сельском хозяйстве медный купорос применяется как антисептик, фунгицид и медно-серное удобрение. Для обеззараживания ран деревьев используется 1%-ный раствор (100 г на 10 л), который втирается в предварительно зачищенные повреждённые участки. Против фитофтороза томатов и картофеля производятся опрыскивания посадок 0,2 % раствором (20 г на 10 л) при первых признаках заболевания, а также для профилактики при угрозе возникновения болезни (например, в сырую влажную погоду). Раствором сульфата меди поливается почва для обеззараживания и восполнения недостатка серы и меди (5 г на 10 л). Однако чаще медный купорос применяется в составе бордо́ской жидкости — основного сульфата меди CuSO4·3Cu(OH)2 против грибковых заболеваний и виноградной филлоксеры. Для этих целей сульфат меди(II) имеется в розничной торговле.
Для борьбы с цветением воды в водохранилищах также используется химическая обработка медным купоросом [8] .
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и в составе прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519. Используется как фиксатор окраски и консервант.
В быту применяют для выведения пятен ржавчины на потолке после затоплений.
В пунктах скупки лома цветных металлов раствор медного купороса применяется для выявления цинка, марганца и магния в алюминиевых сплавах и нержавейке. При выявлении этих металлов появляются красные пятна.
Токсикология [ править | править код ]
Сульфат меди(II) является соединением с умеренной токсичностью и относится к классу опасности 4 (малоопасное вещество). Смертельная доза медного купороса составляет от 45 до 125 граммов для взрослого человека перорально (при проглатывании), в зависимости от массы, состояния здоровья, иммунитета к избытку меди и от других факторов. Признаки отравления становится заметным при разовом потреблении более 0,5 г соединения внутрь (т. н. токсическая доза). LD50 для крыс 612,9 мг/кг [2] . Картина отравления при вдыхании аэрозолей более сложна.
Попадание на кожу сухого вещества безопасно, но его необходимо смыть. Аналогично при попадании растворов и увлажнённого твердого вещества. При попадании в глаза необходимо обильно промыть их проточной водой (слабой струёй). При попадании в желудочно-кишечный тракт твердого вещества или концентрированных растворов необходимо промыть желудок пострадавшего 0,1 % раствором марганцовки, дать выпить пострадавшему солевое слабительное — сульфат магния 1—2 ложки, вызвать рвоту, дать мочегонное. Кроме того, попадание в рот и желудок безводного вещества может вызвать термические ожоги.
Слабые растворы сульфата меди при приёме внутрь действуют как сильное рвотное средство и иногда применяются для провоцирования рвоты.
При работе с порошками и пылью сульфата меди(II), следует соблюдать осторожность и не допускать их пыления, необходимо использовать маску или респиратор, а после работы вымыть лицо. Острая токсическая доза при вдыхании аэрозоля — 11 мг/кг [9] . При попадании сульфата меди через дыхательные пути в виде аэрозоля нужно вывести пострадавшего на свежий воздух, прополоскать рот водой и промыть крылья носа.
Хранить вещество следует в сухом прохладном месте, в плотно закрытой жесткой пластиковой или стеклянной упаковке, отдельно от лекарств, пищевых продуктов и кормов для животных, в недоступном для детей и животных месте.




