Содержание
ГОСУДАРСТВЕННЫЙ СТАНДАРТ СОЮЗА ССР
Определение нитратов ионометрическим методом
Soils. Determination of nitrates by ionometric method
Срок действия с 01.07.87
до 01.07.92*
_______________________________
* Ограничение срока действия снято
Постановлением Госстандарта СССР от 18.12.91 N 1994
(ИУС N 3, 1992 год). – Примечание "КОДЕКС".
РАЗРАБОТАН Государственным агропромышленным комитетом СССР
ИСПОЛНИТЕЛИ
Л.М.Державин, С.Г.Самохвалов, Н.В.Соколова, В.Г.Примакова, М.Н.Арсеньева, Т.С.Груздева, Г.К.Кондратьева
ВНЕСЕН Всесоюзным производственно-научным объединением по агрохимическому обслуживанию сельского хозяйства Госагропрома СССР
1. МЕТОД ОТБОРА ПРОБ
1. МЕТОД ОТБОРА ПРОБ
1.1. Пробы почвы анализируют в состоянии естественной влажности, но не более чем через 5 ч после их отбора или доводят до воздушно-сухого состояния путем подсушивания при температуре до 40 °С. Допускается хранение проб в состоянии естественной влажности не более 2 сут при температуре 1-5 °С, после чего они должны быть проанализированы или высушены.
1.2. Пробы в воздушно-сухом состоянии измельчают, пропускают через сито с круглыми отверстыми диаметром 1-2 мм и помещают в коробки или пакеты. Пробу на анализ из коробки отбирают шпателем или ложкой, предварительно (перемешав почву на всю глубину коробки. Из пакетов пробу высыпают на ровную поверхность, тщательно перемешивают, распределяют слоем не более 1 см и отбирают не менее чем из пяти точек пробу для анализа массой 20,0 г.
1.3. Пробы в состоянии естественной влажности тщательно перемешивают, распределяют слоем толщиной не более 1 см на ровной поверхности и отбирают не менее чем из десяти точек пробу для анализа массой 20,0 г. Аналогично отбирают для определения влажности пробу массой 5-10 г.
2. АППАРАТУРА, МАТЕРИАЛЫ И РЕАКТИВЫ
Иономер или рН-метр милливольтметр с погрешностью измерений не более 5 мВ.
Электрод нитратный ионоселективный типа ЭИМ-I, ЭИМ-II, ЭМ-NО -01 или электрод, имеющий такие же технические и метрологические характеристики.
Электрод сравнения хлорсеребряный насыщенный образцовый 2-го разряда по ГОСТ 17792-72 или электрод, имеющий такие же технические и метрологические характеристики.
Мешалка лабораторная электромеханическая или встряхиватель с возвратно-поступательным движением с частотой колебаний не менее 75 мин .
Термостат с автоматической регулировкой температуры в пределах (105±5) °С.
Весы лабораторные 2-го класса точности с наибольшим пределом взвешивания 200 г и 4-го класса точности с наибольшим пределом взвешивания 500 г по ГОСТ 24104-80.
Весы квадрантные с устройством пропорционального дозирования ВКПД-40 г с погрешностью дозирования не более 2%.
Дозаторы с погрешностью дозирования не более 1% или цилиндры исполнения 1 или 2 вместимостью 50 см по ГОСТ 1770-74.
Колбы мерные, исполнения 1 или 2, 2-го класса точности, вместимостью 1000 см по ГОСТ 1770-74.
Пипетки и бюретки исполнения 1, 2, 3, 4, 5, 2-го класса точности по ГОСТ 20292-74.
Стаканы химические, исполнения 1 или 2, вместимостью 50 см по ГОСТ 25336-82.
Кассеты десятипозиционные с технологическими емкостями или колбы конические исполнения 1 или 2, вместимостью 250 см , по ГОСТ 25336-82.
Бумага фильтровальная по ГОСТ 12026-76.
Квасцы алюмокалиевые, ч.д.а., по ГОСТ 4329-77.
Калий азотнокислый, х.ч., по ГОСТ 4217-77.
Калий хлористый, х.ч., по ГОСТ 4234-77.
Вода дистиллированная по ГОСТ 6709-72.
Калий сернокислый по ГОСТ 4145-74, ч.д.а., раствор концентрации =1 моль/дм (1 н.).
3. ПОДГОТОВКА К АНАЛИЗУ
3.2. Приготовление растворов сравнения
3.2.1. Приготовление раствора концентрации =0,1 моль/дм ( )=1.
10,11 г азотнокислого калия, высушенного до постоянной массы при температуре (105±5) °С, взвешивают с погрешностью не более 0,01 г, помещают в мерную колбу вместимостью 1000 см и растворяют в экстрагирующем растворе, доводя объем до метки.
Раствор хранят в склянке с притертой пробкой не более 1 г. При появлении мути или осадка раствор заменяют свежеприготовленным.
3.2.2. Приготовление раствора концентрации =0,01 моль/дм ( =2).
Готовят 10-кратным разбавлением раствора, приготовленного по п.3.2.1 экстрагирующим раствором в день проведения анализа.
3.2.3. Приготовление раствора концентрации =0,001 моль/дм ( =3).
Готовят 10-кратным разбавлением раствора, приготовленного по 3.2.2 экстрагирующим раствором в день проведения анализа.
3.2.4. Приготовление раствора концентрации =0,0001 моль/дм ( =4).
Готовят 10-кратным разбавлением раствора, приготовленного по п.3.2.3, экстрагирующим раствором.
Раствор готовят в день проведения анализа.
3.3. Приготовление приэлектродного раствора
10,11 г азотнокислого калия и 0,37 г хлористого калия, взвешенных с погрешностью не более 0,01 г, помещают в мерную колбу вместимостью 1000 см и растворяют в дистиллированной воде, доводя объем до метки,
Раствор хранят в склянке с притертой пробкой не более 1 г. При появлении мути или осадка раствор заменяют свежеприготовленным.
3.4. Подготовка электродов к работе
Новый нитратный ионоселективный электрод тщательно промывают дистиллированной водой и ополаскивают приэлектродным раствором. Затем электрод заполняют приэлектродным раствором и выдерживают в течение 24 ч в растворе концентрации =0,1 моль/дм . После этого электрод помещают на 10 мин в дистиллированную воду, промокают фильтровальной бумагой и проверяют его функцию, используя растворы сравнения. В диапазоне от 2 до 4 единиц электрод должен иметь линейную функцию с наклоном (56±3) мВ на единицу . Если характеристика отличается от заданной, электрод непригоден для работы. В перерывах между работой электрод хранят в растворе концентрации =0,1 моль/дм .
Электрод сравнения готовят к работе в соответствии с инструкцией завода-изготовителя. В перерывах между работой электрод хранят в дистиллированной воде. Первичная и периодическая поверка электрода – по ГОСТ 8.149-75.
4. ПРОВЕДЕНИЕ АНАЛИЗА
4.1. Пробы почвы массой 20,0 г взвешивают с погрешностью не более 0,1 г и помещают в технологические емкости или конические колбы. К пробам приливают по 50 см экстрагирующего раствора. Пробу с раствором перемешивают на электромеханической мешалке или встряхивателе в течение 3 мин. Полученные суспензии используют для определения нитратов.
При использовании весов с устройством пропорционального дозирования экстрагента допускается отбор пробы массой 15,0-25,0 г. Допускается пропорциональное изменение массы пробы почвы и объема экстрагирующего раствора при погрешности дозирования не более 2%.
4.2. Определение нитратов
Перед измерением нитратный ионоселективный электрод тщательно ополаскивают дистиллированной водой и выдерживают его в дистиллированной воде в течение 10 мин.
При непосредственном определении прибор настраивают по растворам сравнения равными 4 и 2, используя для контроля раствор равное 3. При этом отклонения значений не должны превышать 0,02 единицы от номинального значения контрольного раствора сравнения.
При измерении в милливольтах электродную пару погружают в растворы сравнения, начиная с меньшей концентрации и определяют ЭДС.
После градуировки прибора электроды тщательно ополаскивают дистиллированной водой, промокают фильтровальной бумагой и приступают к определению нитратов в суспензиях.
Перед измерениями суспензии взбалтывают. Электродную пару погружают в суспензию и считывают показания прибора не ранее, чем через 1 мин после прекращения заметного дрейфа показаний прибора.
Настройку прибора проверяют по растворам сравнения не менее трех раз в течение рабочего дня, используя каждый раз свежие порции растворов сравнения. Температура анализируемых вытяжек и растворов сравнения должна быть одинаковой.
5. ОБРАБОТКА РЕЗУЛЬТАТОВ
5.1. При непосредственном измерении массовую долю азота нитратов в почве в миллионных долях определяют с помощью таблицы пересчета по величине .
Пересчет в массовую долю азота нитратов в почве, млн (мг на 1 кг почвы)

Дата публикации: 28.01.2019 2019-01-28
Статья просмотрена: 361 раз
Библиографическое описание:
Бусыгин В. О., Бунин А. А., Даниленко Ю. А. Содержание нитратной и аммонийной форм азота в почвах санатория «Сосновая роща» и обеспеченность ими растений // Молодой ученый. 2019. №5. С. 85-88. URL https://moluch.ru/archive/243/56065/ (дата обращения: 09.11.2019).
Целью данной статьи является анализ почв санатория «Сосновая роща» на наличие и доступность минерального кремния для растений. В ходе данной работы, с помощью проведённых опытов, была выявлена взаимосвязь между показателем pH почвы и обеспеченностью азотом растений, так же экспериментально было определено содержание нитратного и аммонийного азота и описаны некоторые факторы, влияющие на их содержание в почве. Данная статья будет полезна при разработке мер по сохранению биоразнообразия данной территории.
The purpose of this article is to analyze the soil of the sanatorium «Sosnovaya rosha» for the presence and availability of mineral silicon for plants. In the course of this work, using the conducted experiments, the relationship between the soil pH value and the plant nitrogen supply was found, the content of nitrate and ammonium nitrogen was also experimentally determined and some factors affecting their content in the soil were described. This article will be useful in the development of measures to preserve the biodiversity of the territory.
Сложно переоценить значимость азота как элемента, необходимого для развития растительности, особенно во время интенсивного земледелия. Основные его запасы находятся в газовом составе атмосферы, в молекулярной форме. Так же азот существует в составе соединений, образуя более сложные минеральные и органические формы такие как: азотная кислота, азотистое основание, аммиак и др.
Для нормального функционирования и развития растений необходимо контролировать цикл азота. В противном же случае будут наблюдаться признаки дефицита азота к числу которых относится: слабая ветвистость растений, слабое вызревание, повышенная ломкость побегов. Так же азот контролирует синтез белков и ферментов в организме растений, тем самым влияя на все процессы обмена веществ. [1]
При такой значимости азота в настоящее время стремительно возросла необходимость создания наиболее простых и точных методик его определения и изучения процессов миграции в окружающей среде. Сегодня известно, что основными запасами азота является атмосфера, но основной источник азота для растений находится в почве в органической форме. Следовательно, изучение почвы на наличие и доступность азота является наиболее полезным для повышения жизнеспособности растений. Исходя из вышеизложенного, можно считать, что тема содержания соединений азота в почвах является актуальной на сегодняшний день.
Так как по сравнению с органической формой, доля минерального азота в почве не более 3 %, а так же она является единственной формой способной усваиваться растениями [1] то ее было бы более предпочтительнее определять, считая основным показателем обеспеченности растений, чем органическую форму. Минеральный азот может находится в почве в различных ионных формах: аммония (NH4 + ), нитрита (NO2─) и нитрата (NO3─). [2] Нитритная форма азота имеет свойство быстро окисляться до нитратов, [3] поэтому его определение не является целесообразным в рамках нашего исследования.
Объектом исследования в данном случае была выбрана почва рекреационной зоны, санатория «Сосновая роща» Курганской области расположенного в поселке «Искра». Основанием выбора данной местности является повышенная антропогенная нагрузка на территорию, что позволяет видеть показатели азота на территории подверженной рекреационной и туристической нагрузки.
Определение нитратной формы азота в данных почвах производилось известным методом Грандваль-Ляжу, с помощью которого можно наиболее просто и точно определить количество нитратного азота в почве. Метод основан на взаимодействии нитратов с дисульфофеноловой кислотой с образованием тринитрофенола (пикриновая кислота), который в щелочной среде даёт жёлтую окраску за счёт образования тринитрофенолята калия (или натрия в зависимости от используемой щёлочи) в количестве, эквивалентном содержанию нитратов. Интенсивность окраски определяют на фотоколориметре.
Определение аммонийного азота проводилось колориметрическим методом, основанным на взаимодействии хлорида аммония с реактивом Несслера, при котором образуется йодистый меркураммоний, окрашенный в желтый цвет. По интенсивности окраски можно судить о содержании аммонийной формы азота.
Полученные данные о содержании минеральных форм азота в почвенных образцах представлены на рис. 1

Рис. 1. Содержание нитратного и аммонийного азота в почвах снт «Сосновая роща»
Анализируя полученные данные можно сделать вывод что почвы санатория обладают недостаточным количеством определяемых форм азота. Особенно это относится к нитратной форме. Причин этому может быть несколько:
- Нитраты обладают высокой подвижностью и как следствие могут быть вымыты из почвы.
- Может быть замедлен сам процесс нитрификации (переход азота из аммонийной формы в нитрат). Подкисленная и щелочная почва неблагоприятна для нитрификации и способствует накоплению аммония в почве. [4]
- Содержание нитратов напрямую зависит от плодородия почвы. Чем выше гумус в почвенном покрове, тем больше будет содержание нитратов.
Наиболее низким показателем нитратного азота обладает образец из побережья озера Горькое. Это скорее всего связано с тем, что в озере находится высокое содержание сульфатов и солей натрия. Данные элементы в повышенной концентрации будут находится и в прибрежных районах влияя на доступность азота. Например, сульфат аммония может существенно подкислять почву, замедляя процесс нитрификации. А возможное повышенное содержание цинка или алюминия выступает катализатором при поглощении растений нитратами. [4]
На основе шкалы, представленной в таблице 1, можно говорить о достаточности содержания аммонийного азота в почвах. При недостаточном количестве нитратного азота, почвы санатория обладают средним количеством аммонийного азота. Если говорить не об содержании, а именно о обеспеченности минеральными формами азота растений, то необходимо учитывать показатель Ph территории. Данные Ph представлены на рис. 2
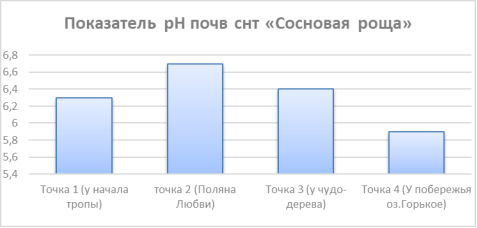 .
.
Рис. 2. Показатель Ph почв снт «Сосновая роща»
Шкала обеспеченности нитратной иаммонийной формами азота почв Западной Сибири (по Гамзикову, 1981)
Содержание NО3, (мг/кг)
Обеспеченность растений азотом
Содержание NH4+ (мг/кг)
Главным выводом из рисунка 1, наталкивающим на мысль об обеспеченности минеральной формой азота, является то, что содержание нитратной и аммонийной формы не имеет прямой односторонней зависимости друг с другом. С повышением одной формы, вторая может непропорционально повышаться или понижаться. Следовательно, необходимо учитывать и иные факторы, влияющие на обеспеченность азотом растений. Одним из них является pH среды, фактор, регулирующий интенсивность процессов миграции азота из различных форм. Так как в точках 2 и 4 наблюдается максимальная разница в показателе pH, необходимо было провести их анализ на состав растительности в территории. Было выявлено, что на Поляне Любви находились ягодные растения (черника, брусника, голубика), а у побережья озера наблюдались растения лесостепных и степных сообществ (бобовые). Так как у этих групп растений различная требовательность к содержанию азота и у них будет и различная обеспеченность этим элементом, где связующим звеном выступает в данном случае pH среды. Так растения, произрастающие преимущественно на подкисленной почве более предрасположены к питанию аммонийной формой, которая имеет свойство подкислять среду. [5]
В заключение бы хотелось отметить, что показатель pH среды не является единственным фактором влияющим на обеспеченность азотом растений. При оценке обеспеченности необходимо так же учитывать гранулометрический состав почвы, способность к аэрации, влажность, наличие токсичных элементов и т. д. Учет данных факторов позволит наиболее рационально применять минеральные удобрения для поддержания биоразнообразия и эффективно производить рекультивационные работы поврежденных территорий.
1. Кидин В. В., Торшин С. П. Агрохимия.-Учебник МСХА им. К. А. Тимирязева. ООО «Проспект», 2015г
2. Методы биодиагностики наземных экосистем: монография / [К. Ш. Казеев, С. И. Колесников, Ю. В. Акименко, Е. В. Даденко] Южный федеральный университет. –Ростов-на-Дону: Издательство Южного федерального университета, 2016. -356с.
3. Бусев А. И. Колометрические (фотометрические) методы определения неметаллов. Издательство иностранной литературы.-Москва 1963г.-156с
4. А Шмук, Гаврилов Н. Н. Труды: Динамика режима питательных веществ в почве Пищепромиздат, 1953
 Азот играет важную роль в оплодотворении сельскохозяйственных культур как с экономической, так и с экологической точки зрения. Различные формы азота в почве в доступной форме растения — нитрат (NH3-) и аммоний (NH4 +). Поведение этих двух форм азота в почве очень отличается.
Азот играет важную роль в оплодотворении сельскохозяйственных культур как с экономической, так и с экологической точки зрения. Различные формы азота в почве в доступной форме растения — нитрат (NH3-) и аммоний (NH4 +). Поведение этих двух форм азота в почве очень отличается.
Нитраты, в силу своей высокой растворимости, легко вымываются из оросительной воды или дождь в более глубокие слои почвы, где корни не могут поглощать их. С другой стороны, азот в виде аммония может сохраняться в почве (глинисто-гумусовый комплекс) через его положительный электрический заряд и неподверженность к вымыванию или потери денитрификации (газообразных). Сбалансированные поставки аммиачного азота и нитратного азота имеют важное значение для оптимизации роста растений и качества продукции.
Исследование по этому направлению:
В почву аммонийный азот может поступать из удобрений или органического вещества. Она должна быть в корневой системе. Многие бактерии, живущие в почве превращают азот аммония в нитратный азот (NH3-). Это может произойти достаточно быстро, учитывая правильные условия почвы и температуру. Благодаря этому процессу большинство азота, поглощается растениями, представляет собой нитратный азот. Нитратный азот очень подвижный в почве и легко доступен для растений. Любой нитратный азот, не обрабатывается растениями, находится под угрозой утечки или потери денитрификации. Выделенные газы включают оксид азота.
В нормальных условиях минеральные удобрения, содержащие аммиак, должны расщепляться в почве до нитратов — форм азота, которые менее токсичны для растений, чем аммиак. Однако этот процесс расщепления, известный как нитрификация, может быть подавленным, если в почве низкое содержание кислорода (через уплотнения, плохой дренаж, микробные популяции и т.д.). Накопление токсичных уровней аммония происходит летом, когда в почвах не хватает кислорода.
Нитрификация — естественный процесс в почве, где аммонийный азот (NH4 +) с удобрений или органических форм окисляется до нитратного азота (NO3-). Нитрификация осуществляется избранными почвенными бактериями в два этапа.
Первым шагом является окисление аммонийного азота до нитратного азота (NO2-), однако существуют и другие микроорганизмы, такие как археи, приводящие к нитрификации в некоторых почвах. На втором этапе происходит окисление нитратного азота в азот аминогруппы. Большинство видов сельскохозяйственных культур могут принимать азот как в форме аммония, так и в нитратах. Механизм поглощения отличается тем, что подвижные нитраты могут перемещаться к корням в грунтовой воде с помощью массового потока, тогда как по корням движутся к менее подвижных нитратов аммония, которые имеют тенденцию связываться с отрицательно заряженной глины и частиц органического вещества.
Скорость нитрификации зависит от ряда факторов, в частности влажности и температуры почвы, в почве с оптимальными условиями влажности и температуры для роста растений применения аммиачного азота, как ожидается, в большинстве случаев будет нитрификовано в течение двух недель.
Другие материалы по этому направлению:
Уровень азота, который является слишком низким (менее 3 части на миллион) может представлять угрозу для растения. Уровни общего азота (сумма аммонийного азота и нитратного азота), которые превышают 20 частей на миллион, могут нанести вред корням. Даже если общие показатели азота менее 20 частей на миллион, то будут наблюдаться проблемы, связанные с наличием аммония в почве. Относительно низкие концентрации аммония (7 частей на миллион или больше) связаны с повреждением корней. Таким образом, в почве может быть концентрация с общим азотом 15 частей на миллион (5 частей на миллион нитратного азота и 10 частей на миллион аммонийного азота).
Аммонийный азот, как правило, доступен для поглощения растений, не поддается двум основным механизмам потери азота: выщелачивания (движение нитратного азота из корневой зоны в грунтовой воде) и денитрификация (потеря азота в виде оксид азота или газ азота на заболоченной местности). Аммонийный азот стимулирует дополнительный рост по сравнению с нитратным азотом. Поглощение аммонийного азота является более энергоэффективным на предприятии, так как нитратный азот должен быть восстановлен до аммонийного азота как предшественник производства аминокислот растения.